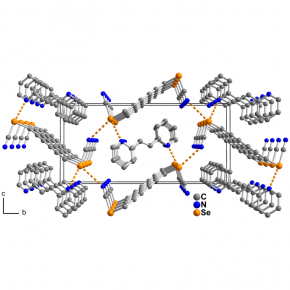
La liaison chalcogène : un outil d’ingénierie cristalline ?
Les interactions entre molécules comme la liaison hydrogène, omniprésente dans le vivant, peuvent être manipulées pour contrôler l’orientation relative de molécules dans des cristaux, et en particulier l’association de deux molécules différentes dans un co-cristal. Dans le cadre d’une collaboration entre l’Institut des sciences chimiques de Rennes (ISCR, CNRS/ENSCR/Université Rennes 1) et le CRM2 (CNRS/Université de Lorraine), des chimistes ont démontré qu’une autre interaction intermoléculaire faible, appelée liaison chalcogène, pouvait organiser dans un cristal des molécules réactives de façon si précise qu’un simple chauffage permet leur polymérisation contrôlée, dans une rare réaction dite topochimique. Une avancée dans ce domaine de l’ingénierie cristalline, à retrouver dans la revue Angewandte Chemie.
Les interactions intermoléculaires comme la liaison hydrogène, de par leur force et leur prédictibilité, sont couramment utilisées comme outil d’ingénierie cristalline pour contrôler non seulement l’organisation supramoléculaire, mais aussi la réactivité de cristaux moléculaires. Ces interactions jouent un rôle crucial en chimie du vivant, comme dans la mise en œuvre de principes pharmaceutiques, mais aussi en science des matériaux pour influer sur les propriétés mécaniques, optiques, électriques, magnétiques de solides cristallins. Ces dernières années, une autre famille d’interactions, dites interactions sigma-hole, ont été mises en avant comme outil de contrôle et d’organisation de systèmes supramoléculaires en solution, mais aussi, et surtout, à l’état solide cristallin dans des co-cristaux. Ces interactions sont basées sur la polarisation anisotrope du nuage électronique d’halogènes (I, Br) ou de chalcogènes (Te, Se), qui génère une zone électropositive dans le prolongement de la ou des liaisons covalentes portées par ces atomes. Cette zone électropositive peut interagir avec d’autres zones électronégatives, comme le fait un hydrogène dans la liaison hydrogène, conduisant à des motifs d’association récurrents à l’état solide.